Individuelle Krebstherapie ohne Tierversuche
Einen Tumor mit mehreren Gegnern besiegen
Hört sich unfair an? Aber Fairplay ist hier nicht angebracht, denn ein Tumor hat viele heimtückische Gesichter. Er besteht aus verschiedenen Variationen mutierter Zellen, die meist nicht alle auf denselben Wirkstoff einer Chemotherapie ansprechen. Durch die Verwendung von Patienten-abgeleiteten 3D Tumormodellen in einem neuen Verfahren wollen das Fraunhofer IZI-BB und die CELLphenomics GmbH Wirkstoffkombinationen individualisiert testen. Ganz ohne Tierversuche könnte so dem Krebs der Garaus gemacht werden.
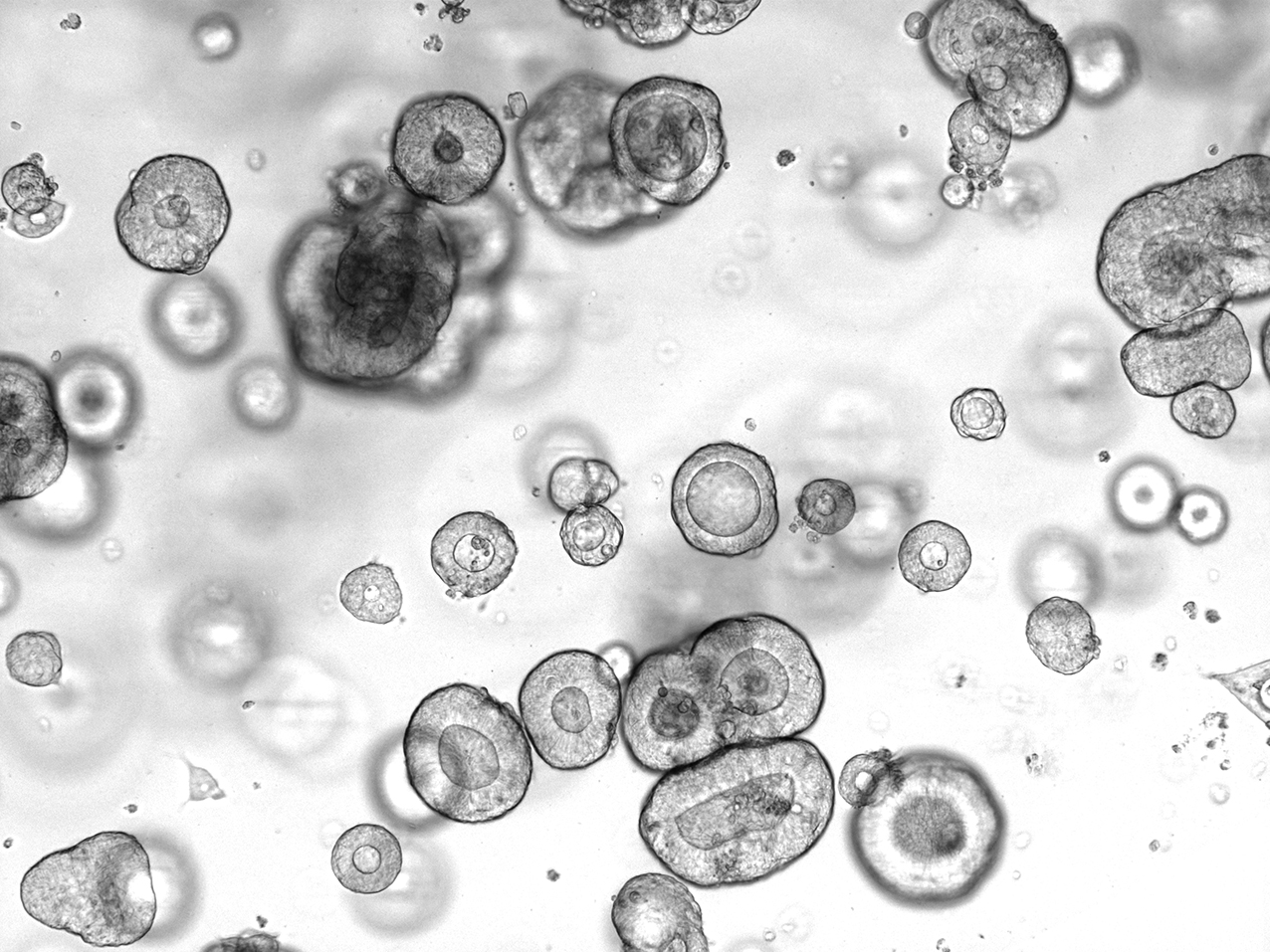
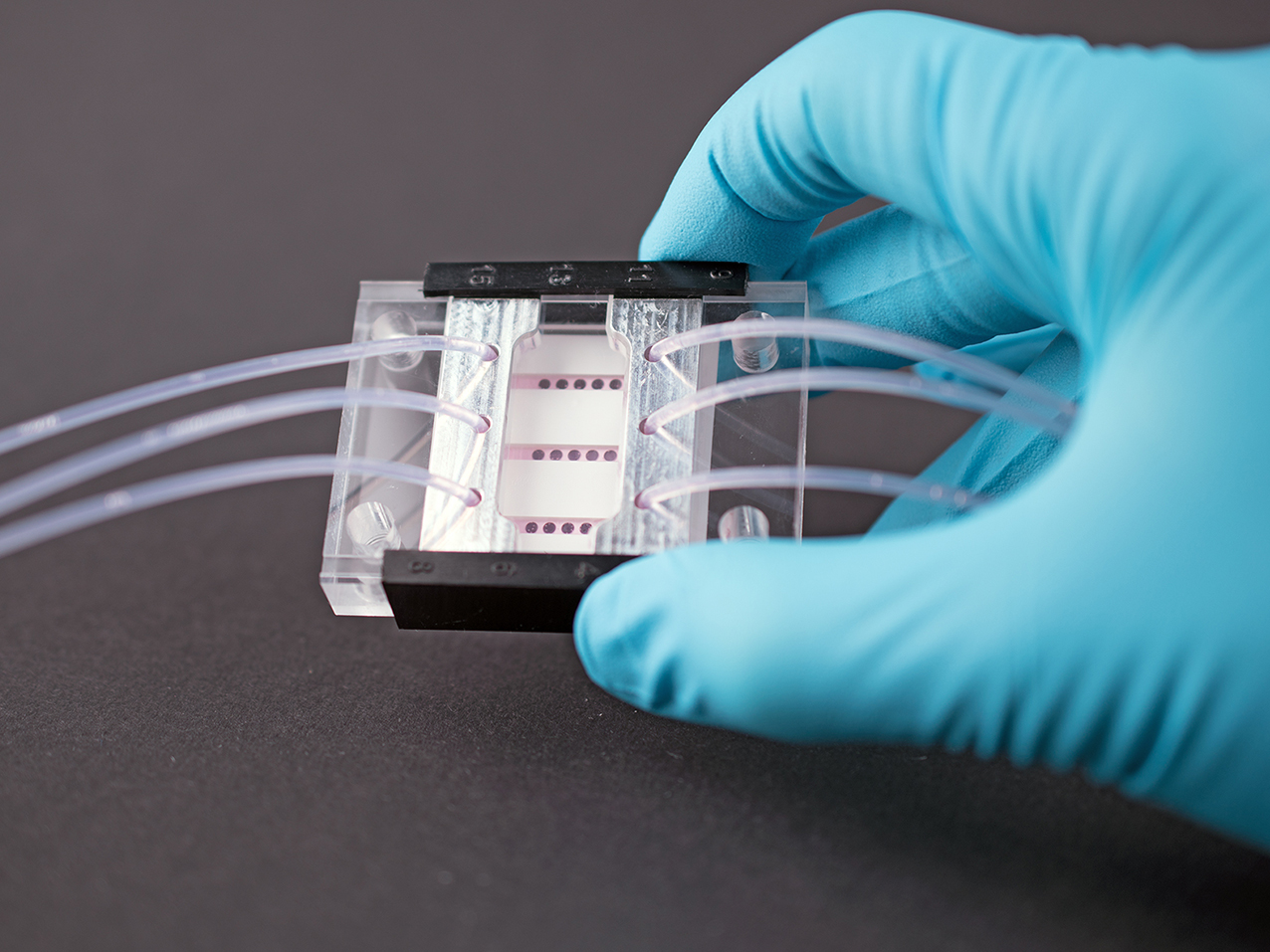
Ob eine an Krebs erkrankte Person die richtige und somit eine vielversprechende Therapie erhält, zeigt sich leider meist erst während oder nach der Behandlungsprozedur. Das kann für Patientinnen und Patienten verheerende Folgen haben, da hier wertvolle Zeit verstreicht. Seit kurzem ermöglicht die CELLphenomics GmbH in Zusammenarbeit mit der ASC Oncology GmbH das Testen verschiedener Medikamente anhand von individuellen Tumormodellen. Dafür werden den Erkrankten Tumorzellen entnommen, die in einem Labor zu Miniorganen, also einer Vielzahl von Miniaturausgaben des Tumors gezüchtet werden. Mit diesen sogenannten Organoiden wird dann die Wirksamkeit unterschiedlicher Medikamente getestet und ein Therapieplan entworfen.
Um diese Methode noch zu verfeinern, wird Dr. Katja Uhlig vom Fraunhofer Institut für Zelltherapie und Immunologie, Institutsteil für Bioanalytik und Bioprozesse (IZI-BB) – gemeinsam mit Dr. Christian Regenbrecht und Dr. Lena Wedeken von der CELLphenomics GmbH in einem vom BMBF geförderten Verbundprojekt einen Chip für diese Modelle entwickeln, der die natürliche Umgebung im menschlichen Organismus nachahmt und durch eine kontrollierte Umgebung das Testen von Wirkstoffkombinationen erlaubt. Durch den Einsatz von Mini-Sensoren kann im Gegensatz zu den herkömmlichen Methoden der Einfluss der Medikamente in Echtzeit verfolgt werden. Das Ziel ist nicht nur die Wirkstoffkombination zu optimieren, sondern auch die Dosis und den Zeitpunkt der Verabreichung individuell anzupassen. Dieses System kann dabei nicht nur bei der Therapiewahl helfen, sondern auch bei der Entwicklung neuer Wirkstoffe.
Personalisierte Krebstherapie
Die Chance auf eine erfolgreiche Behandlung wird durch die individuelle Untersuchung eines Tumors beträchtlich erhöht. Momentan werden von den Kliniken häufig noch diagnostische Verfahren eingesetzt, die nicht konkret vorhersagen, wer genau von welcher Therapie am meisten profitiert. Eine personalisierte Onkologie bedeutet heutzutage meist eine Sequenzierung des Tumorgenoms – welche allerdings nur begrenzte Aussagekraft für die Therapieentscheidung hat – und in klinischen Studien bisher nur in max. 10% der Fälle zum Erfolg führte.[i] Individuelle Tumormodelle, an welchen die verschiedenen Therapeutika getestet werden, könnten hier einen Lösungsweg aufzeigen. Hier werden einer an Krebs erkrankten Person Tumorzellen entnommen und im Labor mit potentiellen Wirkstoffen in Berührung gebracht. Bisher macht man die Untersuchungen meist über sogenannte 2D-Tumorzelllinen, die kostengünstig und leicht hochskalierbar sind. Diese Modelle repräsentieren jedoch nur näherungsweise die Situation im Menschen und liefern wenig belastbare Aussagen für die Therapieentscheidung. Werden die Tumorzellen in Mäuse transplantiert, wird die Komplexität berücksichtigt, allerdings für die falsche Spezies. Menschen sind nun mal keine Mäuse. Und die Ergebnisse von Tierversuchen sind nicht 1 zu 1 auf den Menschen übertragbar. Verbreitete personalisierte Tests an Tiermodellen würden zudem die Anzahl an Versuchstieren stark anwachsen lassen, was ethisch kaum vertretbar wäre.
3D-Zellmodelle statt Tierversuche
Mit Patienten-abgeleiteten 3D-Zellmodellen hat man die Möglichkeit die Situation im Menschen und deren individuellen Tumoren deutlich wirklichkeitsgetreuer abzubilden. Die CELLphenomics GmbH hat sich auf die Kultivierung und Untersuchung von solchen 3D-Zellmodellen spezialisiert. Dem Patienten entnommene Tumorzellen werden dafür in einer Umgebung kultiviert, in welcher die spezifischen Eigenschaften der Zellen über viele Zellteilungen hinweg bewahrt werden.[ii],[iii] In 3D können die Zellen zu kleinen Organoiden wachsen, die auch die unterschiedlichen Variationen der Mutationen aufweisen und die Architektur des ursprünglichen Tumors widerspiegeln.[iv] Diese Organoide sind als Tumormodell etabliert und können umfassende Informationen zur Sensitivität eines Tumors auf eine bestimmte Chemotherapie liefern.[v] Das analytisch nächsthöhere Level wird erreicht, wenn diese Mini-Tumore in durchströmte Chips integriert werden, die durch Zu- und Abfluss über kleine Schläuche konstant mit Nährmedium oder auch Wirkstoffen versorgt werden können. Diesen Versuchsaufbau nennt man auch Organ-on-Chip-System. Stand der Technik ist hier, dass die Zellen meist nur zu einem Zeitpunkt, dem Versuchsende, auf ihre Aktivität hin untersucht werden. Es wurde jedoch bereits ein Organ-on-Chip-System entwickelt, welches eine kontinuierliche Messung der Zellvitalität über längere Zeit erlaubt. Dr. Katja Uhlig vom Fraunhofer IZI-BB war an dieser Entwicklung maßgeblich beteiligt. Durch diese Methode können die Forschenden erstmals in Echtzeit Effekte im Labor beobachten, die ausschließlich durch die Kombination oder die Mehrfachgabe von Wirkstoffen erreicht werden. Dr. Katja Uhlig vom Fraunhofer IZI-BB wird gemeinsam mit Dr. Christian Regenbrecht und Dr. Lena Wedeken von der CELLphenomics GmbH das Organ-on-Chip-System mit den 3D-Zellmodellen im BMBF-Verbundprojekt TumOC (Tumor-On-Chip) verknüpfen. Die Vorhersage in Bezug auf die Wirksamkeit einer Krebstherapie könnte durch dieses Projekt so weit verbessert werden, dass viele Tierversuche ersetzt werden könnten.
Wirkstoffscreening
Eine Tumor-On-Chip-Untersuchung benötigt je nach Versuchsanordnung einige Tage. Momentan können im Versuchsaufbau 12 Proben gleichzeitig gemessen werden, was die Anzahl der getesteten Substanzen stark einschränkt. Die CELLphenomics GmbH führt daher vorab ein Hochdurchsatz-Screening durch bei dem zahlreiche Chemotherapeutika an den 3D Modellen getestet werden. Die Wirkstoffkandidaten, die sich in diesem Probelauf bewährt haben, können im Nachgang durch das Tumor-on-Chip-System detailliert getestet werden. Vor allem wenn die unterschiedlichen Zellmutationen in einem Tumor nicht alle auf dasselbe Therapeutikum ansprechen, kann durch eine Kombination unterschiedlicher Wirkstoffe dennoch eine effektive Therapie entwickelt werden. Nach einem erfolgreichen Abschluss des Forschungsprojekts könnten Patienten und Patientinnen diesen Service tatsächlich in Anspruch nehmen und für ihren individuellen Krebs eine personalisierte Therapie finden.
Projektstart im Juni 2021
Durch den VDI/VDE-IT wurde die Förderung im »Rahmenprogramm Gesundheitsforschung« des BMBF, dem Bundesministerium für Bildung und Forschung, ausgeschrieben. Das Verbundprojekt TumOC startet am 1. Juni 2021 und erfährt zusätzlich ein Mentoring durch das Bundesinstitut für Risikobewertung.
Literatur:
[i] V. Prasad, „Perspective: The precision-oncology illusion“, Nature, Bd. 537, Nr. 7619, S. S63–S63, Sep. 2016, doi: 10.1038/537S63a.
[ii] M. Schütte u. a., „Molecular dissection of colorectal cancer in pre-clinical models identifies biomarkers predicting sensitivity to EGFR inhibitors“, Nat. Commun., Bd. 8, Nr. 1, Apr. 2017, doi: 10.1038/ncomms14262.
[iii] D. Schumacher u. a., „Heterogeneous pathway activation and drug response modelled in colorectal-tumor-derived 3D cultures“, PLOS Genet., Bd. 15, Nr. 3, S. e1008076, März 2019, doi: 10.1371/journal.pgen.1008076.
[iv] J. F. Linnekamp u. a., „Consensus molecular subtypes of colorectal cancer are recapitulated in in vitro and in vivo models“, Cell Death Differ., Bd. 25, Nr. 3, S. 616–633, März 2018, doi: 10.1038/s41418-017-0011-5.
[v] G. Vlachogiannis u. a., „Patient-derived organoids model treatment response of metastatic gastrointestinal cancers“, Science, Bd. 359, Nr. 6378, S. 920–926, Feb. 2018, doi: 10.1126/science.aao2774.
Die Fraunhofer-Gesellschaft mit Sitz in Deutschland ist die weltweit führende Organisation für anwendungsorientierte Forschung. Mit ihrer Fokussierung auf zukunftsrelevante Schlüsseltechnologien sowie auf die Verwertung der Ergebnisse in Wirtschaft und Industrie spielt sie eine zentrale Rolle im Innovationsprozess. Als Wegweiser und Impulsgeber für innovative Entwicklungen und wissenschaftliche Exzellenz wirkt sie mit an der Gestaltung unserer Gesellschaft und unserer Zukunft. Die 1949 gegründete Organisation betreibt in Deutschland derzeit 75 Institute und Forschungseinrichtungen. Rund 29 000 Mitarbeiterinnen und Mitarbeiter, überwiegend mit natur- oder ingenieurwissenschaftlicher Ausbildung, erarbeiten das jährliche Forschungsvolumen von 2,8 Milliarden Euro. Davon fallen 2,4 Milliarden Euro auf den Leistungsbereich Vertragsforschung.
Die CELLphenomics GmbH ist ein Berliner Biotech Unternehmen, das 2014 als Ausgründung aus der IMI Initiative OncoTrack entstand. Die Kerntechnologie von CELLphenomics sind innovative, Patienten-abgeleiteten 3D Zellkulturmodelle (PD3D®) und deren Anwendung für eine zuverlässige Vorhersage über die Wirksamkeit von (Chemo-)Therapeutika in der Onkologie. Diese Möglichkeit wird insbesondere von der pharmazeutischen Industrie genutzt, um Entwicklungszyklen zu verkürzen und die Kosten für die Zulassung von Wirkstoffen zu senken. Die gleiche Technologie wird in der personalisierten Onkologie von der Schwesterfirma ASC Oncology direkt Onkologen und Patienten angeboten, um vor einer medikamentösen Therapie eines Tumorpatienten die Wirksamkeit von Medikamenten am individuellen Patiententumor vorherzusagen.
 Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB
Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB