Wir bieten anwendungsnahe und kundenspezifische Entwicklungen von Verfahren und Prototypen für die Prozessierung und Handhabung von anspruchsvollen biologischen Proben an. Ein Schwerpunkt ist die Manipulation einzelner Objekte, z.B. die schonende und vielseitige Handhabung einzelner Zellen und besonders kleiner Zellproben in mikrofluidischen Chips. Dazu werden meist elektrische Felder im Radiofrequenzbereich genutzt, was für die Zellen völlig unschädlich ist. Für komplexere Aufgaben werden diese mit komplementären Manipulationsverfahren, wie z.B. optischen Pinzetten oder mikrofluidischen Verfahren kombiniert. Daneben widmen wir uns der Integration von Sensortechnologie in mikrofluidische Bauteile zur Erfassung wichtiger Kenngrößen von Zellen und anderen komplexen, biologischen Proben.
Mikrofluidik und Einzelzelltechnologien

Reiternavigation
Projekte
Einzelzell-Handhabung
Die Arbeitsgruppe verfügt über jahrelange Erfahrung auf dem Gebiet der Handhabung wertvoller Zell-Proben auf Ebene der einzelnen Zelle. Mit Hilfe frei konfigurierbarer Mikroelektroden, die in Mikrofluidiken integriert werden, können einzelne Zellen gezielt aus einer Suspension selektiert werden. Die selektierten Zellen können sortiert und zentrifugationsfrei in andere Medien überführt sowie zum Zwecke der Fusion oder eines Signaltransfers kontrolliert miteinander in Kontakt gebracht werden. Dies ist etwa bei der immunologischen Zellaktivierung oder bei der Initiation der Stammzelldifferenzierung von Interesse. Auch die Quantifizierung von Bindungskräften zwischen zwei Zellen oder mikroskaligen Objekten ist mit unserer Technologie möglich.
Berührungslose Rotation einer Säugetierzelle in einem Dielektrophorese-basierten mikrofluidischen System. Zunächst wird die Zelle mittels dielektrophoretischer Kräfte in einem dielektrischen Feldkäfig gefangen, welcher aus acht Mikroelektroden (im Bild schwarz) besteht: vier am Boden und vier an der Decke des Mikrokanals. Durch das Anlegen von um 90° phasenverschobenen Radiofrequenzfeldern an diese acht Elektroden kann die Zelle um jede beliebige Raumachse rotiert werden. Maßbalken: 10 µm
Einzelzellfusion einer P3X-Myeloma Zelle mit einer B-Zelle in einem dielektrischen Feldkäfig. Individuell ausgewählte Zellen werden zunächst über dielektrophoretische Kräfte gefangen bzw. gepaart, wodurch ihre Zellmembranen in engen Kontakt gebracht werden. Die Fusion der Zellen wird dann durch die Applikation eines kurzen Spannungspuls (im Video durch ein Blitzlicht dargestellt) initiiert. Etwa 2 min. nach Applikation des Pulses beginnt das Abbild der Zellmembranen an der Kontaktstelle zu verschwimmen. Etwa 3 min. nach Pulsapplikation sind die trennenden Membranabschnitte gänzlich verschwunden wodurch sich ein einzelnes Heterokaryon bildet.
Berührungslose Handhabung einzelner Zellen in einem Dielektrophorese-basierten mikrofluidischen System. Durch nacheinander angeordnete Deflektorelemente und dielektrophoretische Weichen (im Video schwarz; aktive Elemente sind durch eine weiße Linie markiert) werden individuell ausgewählte Zellen (Pfeile) von ihren ursprünglichen Trajektorien abgelenkt und quer zu den Strömungslinien im Kanal in ein Zickzack-förmiges Halteelement überführt. Dort werden sie gegen die Flüssigkeitsströmung im Kanal gehalten, wodurch eine Überspülung mit aktiven Substanzen bzw. Farb- und Waschlösungen möglich wird.
Kontaktierung einer einzelnen T-Zelle mit einem bioaktiv beschichteten Mikropartikel in einem Dielektrophorese-basierten mikrofluidischen System. Einzeln ausgewählte Zellen bzw. Partikel werden dielektrophoretisch in ein Zickzack-förmiges Halteelement überführt, wo sie gegen die Flüssigkeitsströmung im Kanal berührungslos gehalten werden. Durch Überführung von Zelle und Partikel in die gleiche Halteposition werden die Objekte miteinander kontaktiert und die T-Zelle somit stimuliert.
Mikropartikel als Sensoren für die Bioanalytik
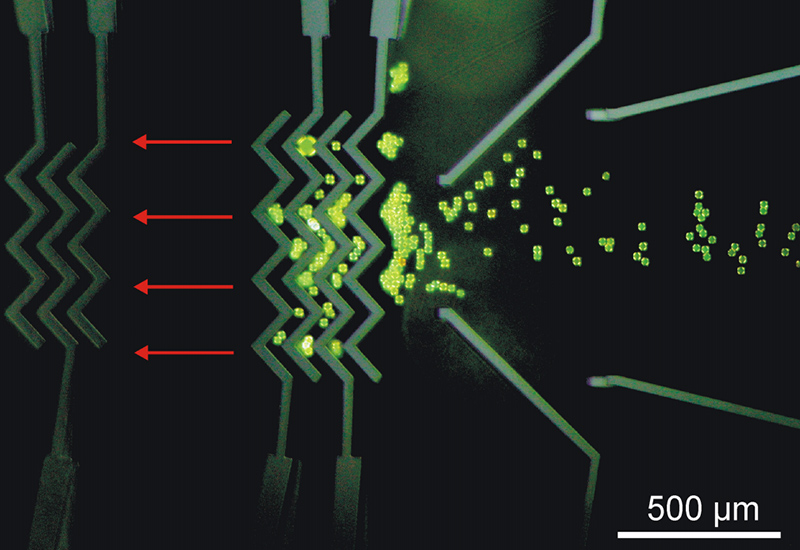
Die meisten bioanalytischen Verfahren erfordern immer noch zu aufwendige und zu kostspielige Komponenten und Gerätschaften. In diesem Projekt werden dielektrische Mikropartikel als Sensoren für Biomoleküle auf der Basis von sog. »Whispering Gallery Modes« (WGM) für den Einsatz in mikrofluidischen Bauteilen entwickelt. Dabei kommen die Vorteile der Partikel optimal zur Geltung: Sie sind sehr flexibel einsetzbar, da sie frei im Analyten diffundieren können, sie benötigen nur kleinste Probenvolumina und zudem können sie mit einfachsten Methoden ausgelesen werden.
Mikrosysteme zur Kontrolle neuronalen Zellwachstums
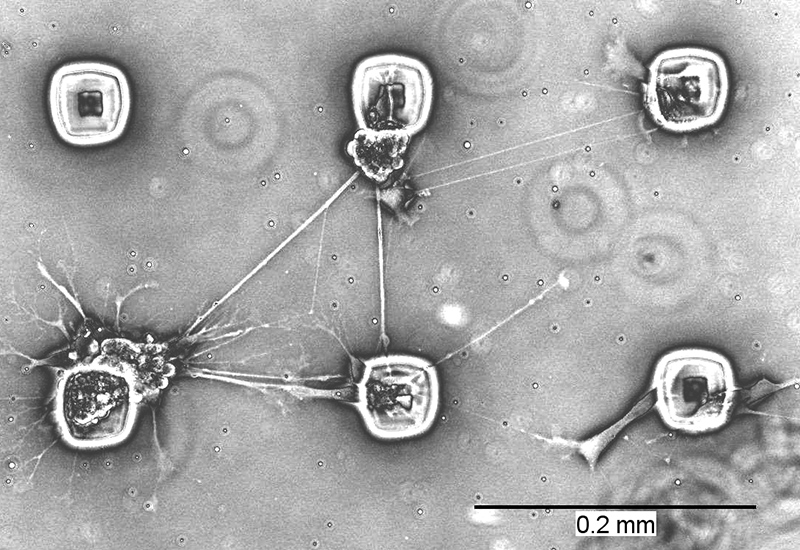
Die Analyse künstlicher neuronaler Netzwerke ist ein vielversprechender Ansatz zur Adressierung zahlreicher neurobiologischer Fragestellungen. Trotz intensiver Bemühungen weltweit ist es jedoch noch nicht in zufriedenstellender Weise gelöst, die synaptische Übertragungsrichtung zwischen den einzelnen Zellen eines solchen Netzwerkes in vitro zu kontrollieren, was z.B. die Aufklärung der Form-Funktion-Beziehung in neuronalem Gewebe erschwert.
Mittels Mikrofertigungstechniken und in enger Kooperation mit der benachbarten Arbeitsgruppe »Mikrosysteme für In-vitro-Zellmodelle« werden in diesem Projekt Zellkultursubstrate mit Oberflächenbeschichtungen aus thermoresponsiven Polymeren (TRP) entwickelt, mit denen neuronale Netzwerke mit definiertem Verbindungsmuster erzeugt werden können. Die hierfür eingesetzten TRP können temperaturabhängig von einem zellabweisenden in einen zelladhäsiven Zustand überführt werden, wodurch die Zugänglichkeit einer TRP-beschichteten Substratoberfläche für Zellen und auswachsende Neurite dynamisch und µm-genau kontrolliert werden kann. Ziel ist es, neue methodische Zugänge zu wichtigen neurowissenschaftlichen Fragestellungen in der Grundlagenforschung oder im Rahmen der pharmazeutischen Wirkstoffentwicklung zu schaffen.
Ein photonisch-mikrofluidisches Produktionsverfahren zur ultraschnellen Herstellung maßgeschneiderter monoklonaler Antikörper
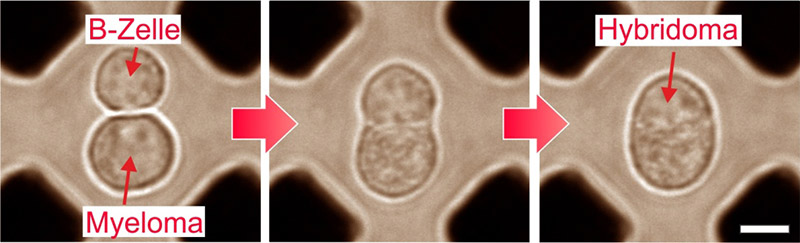

Monoklonale Antikörper gehören zu den weltweit am häufigsten eingesetzten Bindemolekülen. Zentraler Bestandteil des herkömmlichen Produktionsverfahrens ist die (unkontrollierte) Zellfusion von Myeloma- und B-Zellen. Über aufwändige Selektionsschritte müssen hierbei aus Millionen unerwünschter Nebenprodukte einzelne, antikörperproduzierende Zellen mit den gewünschten Bindungseigenschaften identifiziert werden. Dies treibt Aufwand und Kosten der Antikörperentwicklung in enorme Höhen.
Ziel des Vorhabens ist die Etablierung eines Verfahrens, mit dem geeignete B-Zellen bereits im Vorfeld der Fusion fluoreszenzoptisch identifiziert und mittels eines mikrofluidischen Protokolls einer kontrollierten Fusion mit Myeloma-Zellen auf Einzelzell-Ebene zugeführt werden können. Dadurch entfallen die aufwändigen Selektionsschritte nach der Fusion, was Aufwand und Kosten auf ein Minimum reduziert und die Herstellung maßgeschneiderter Antikörper so in weniger als drei Wochen ermöglichen soll.
Das Vorhaben wird in enger Kooperation mit dem Lehrstuhl »Physikalische Chemie« sowie der Arbeitsgruppe »Immuntechnologien« der Universität Potsdam durchgeführt und wird finanziell unterstützt durch die Europäische Union.
Methoden & Geräte
- Design und Aufbau Chip-basierter Mikrosysteme
- Numerische Modellierung von Mikrosystemen mittels der Finite-Elemente-Methode
- Waschen, Charakterisieren, Sortieren und Stimulieren von seltenen und wertvollen Zellproben (z.B. Stammzellen, zirkulierende Tumorzellen)
- Berührungslose Handhabung einzelner Zellen (z.B. Zell-Selektion, Zell-Fusion, Zell-Rotation, Zell-Stimulation, Zell-Charakterisierung, etc.)
- Klonierung zuvor charakterisierter bzw. prozessierter Einzelzellen
- Variables Mikrofluidik Set-up
- Rechnergesteuerte Pumpensysteme
- 32-Kanal-Radiofrequenz Generatoren zur dielektrophoretischen Partikelmanipulation
- Optische Pinzette (Laser Tweezers) mit kombiniertem UV-Laser zum Laser-Schneiden
Partner
- GeSiM Gesellschaft fuer Silizium-Mikrosysteme mbH
- Surflay Nanotec GmbH
- NanoBioAnalytics
- Universität Rostock, Lehrstuhl für Biophysik
- Tel Aviv University, OMNI Group
- microfluidic ChipShop GmbH
- Fraunhofer-Institut für Angewandte Polymerforschung, Forschungsbereich Life Science und Bioprozesse
Publikationen
- Habaza M, Kirschbaum M, Guernth-Marschner C, Dardikman G, Barnea I, Korenstein R, Duschl C, Shaked NT. Rapid 3D Refractive-Index Imaging of Live Cells in Suspension without Labeling Using Dielectrophoretic Cell Rotation. Adv. Sci. (2017), 4, 1600205
- Guernth-Marschner C, Kirschbaum M, Jaeger MS, Duschl C. Electrofusion of cells in microdevices. Cell News. (2013), 39(3), 14-18.
- Kirschbaum M, Gürnth-Marschner CR, Cherré S, de Pablo Peña A, Jäger MS, Kroczek RA, Schnelle T, Müller T, Duschl C. Highly controlled single-cell electrofusion in dielectrophoretic field cages. Lab on a Chip. (2012), 12, S. 443-450.
- Guido I, Xiong C, Jaeger MS, Duschl C. Microfluidic system for cell mechanics analysis through dielectrophoresis. Microelectron Eng. (2012), 97:379-382
- Boettcher M, Schmidt S, Latz A, Jaeger MS, Stuke M, Duschl C. Filtration at the microfluidic level: enrichment of nanoparticles by tunable filters. J Phys Condens Mat. (2011), 23, 324101
- Guido I, Jaeger MS, Duschl C. Dielectrophoretic stretching of cells allows for characterization of their mechanical properties. Eur Biophys J. (2011), 40:281-288.
- Guido I, Jaeger MS, Duschl C. Influence of medium consumption on cell elasticity. Cytotechnology. (2010), 62, 257-263.
- Kirschbaum M, Jaeger MS, Duschl C. Correlating short-term Ca2+ responses with long-term protein expression after activation of single T cells. Lab Chip. (2009), 9, 3517-3525.
- Kirschbaum M, Jaeger MS, Schenkel T, Breinig T, Meyerhans A, Duschl C. T cell activation on a single-cell level in dielectrophoresis-based microfluidic devices. J Chromatogr A. (2008), 1202, 83–89.
- Böttcher M, Jäger MS, Kirschbaum M, Müller T, Schnelle T, Duschl C. Gravitation-driven stress-reduced cell handling. Anal Bioanal Chem. (2008), 390, 857-863.
- Storn V, Kirschbaum M, Schlosshauer B, Mack AF, Fricke C. Electrical stimulation-induced release of beta-endorphin from genetically modified neuro-2a cells. Cell Transplant. (2008), 17(5):543-8
- Jaeger MS, Uhlig K, Schnelle T, Mueller T. Contact-free single-cell cultivation by negative dielectrophoresis. J Phys D Appl Phys. (2008), 41:175502.
- Jaeger MS, Mueller T, Schnelle T. Thermometry in dielectrophoresis chips for contact-free cell handling. J Phys D Appl Phys. (2007), 40:95–105
- Böttcher M, Jäger MS, Riegger L, Ducrée J, Zengerle R, Duschl C. Lab-on-chip-based cell separation by combining dielectrophoresis and centrifugation. BRL. (2006), 1(4):443-451.
 Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB
Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB