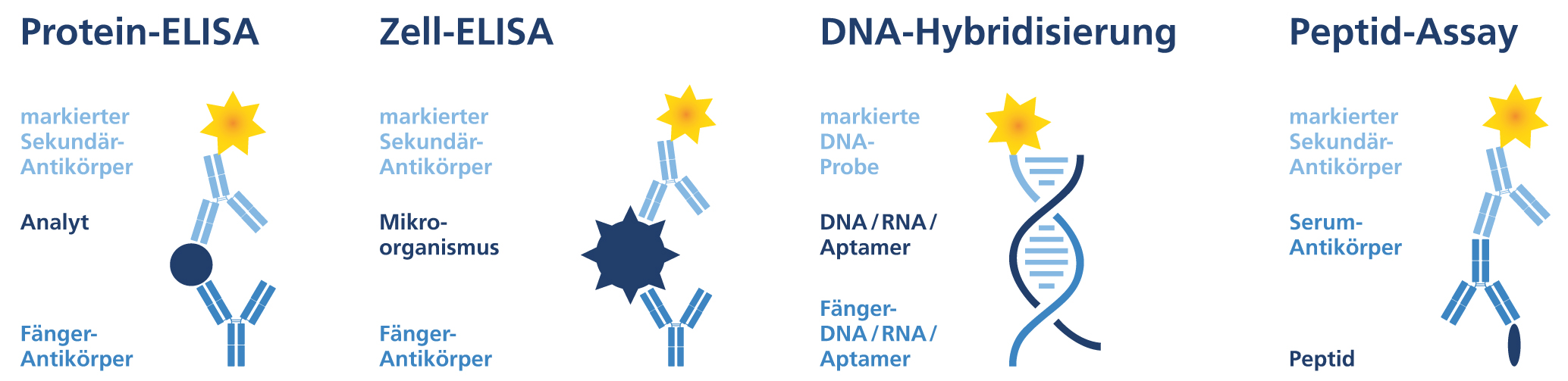
Das Tätigkeitsprofil umfasst im Wesentlichen das Aufbringen definierter Mengen (Spotten) an biologischen Probenmaterial auf eine vordefinierte Oberfläche. Das dabei pro Spot übertragene Volumen kann von einigen wenigen pL bis zu nL oder sogar µL betragen. Die Bandbreite der bearbeiteten (biologischen) Proben reicht von Nukleinsäuren (DNA, RNA und Aptamere) über Peptide und Proteine bis hin zu komplexen Proben wie Serum, Zellextrakt und vitalen Zellen. Mit der vorhandenen Ausstattung können die physiko-chemischen Eigenschaften der Proben berücksichtigt werden und unter identischen Bedingungen diese sehr schonend dispensiert werden. Als Target für die Proben können modifizierte Objektträger (Slides) genauso verwendet werden wie Membranen, Wafer und vorstrukturierte 3-dimensonale Objekte für ivD und Lab-on-a-chip Anwendungen in unterschiedlichen Größen. Das Angebot wird durch die Möglichkeit zur spezifischen Strukturierung und Modifikation von Oberflächen und deren Charakterisierung abgerundet.
Mikroarraytechnologien
Leistungsangebot
- Herstellung (Spotten) kundenspezifischer DNA-, Peptid-, Protein- und Zell-Mikroarrays
- Kompetenzzentrum Dispensiertechnologien
- Spotten auf unterschiedlichen Materialien, z. B. Glas, Plastik, Membranen, Mikrotiterplatten, Leiterbahnen, etc.
- Benchmarking diverser Kontakt- und Nicht-Kontakt-Spotter zur Auswahl des optimalen Systems (Referenzlabor für Liquiddispensiersysteme)
- Durchführung von kundenspezifischen Mikroarray-Experimenten, Auswertung und Dokumentation
- Optimierung der Experimente durch thermodynamische und kinetische Messungen
- Übertragung anderer Assayformate auf Mikroarrays, als Lateral-Flow-Test und für in vitro Diagnostik Anwendungen
- Entwicklung und Etablierung von Assays für ELISA und Mikroarrays
- Kolorimetrische, Fluoreszenz und elektrochemische Nachweissysteme
Zellmikroarrays
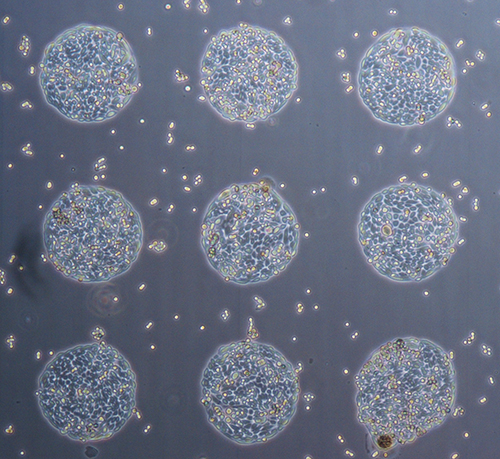
Das Aufbringen von definierten Mengen an Zellen an definierte Orte ist ein wichtiges Thema der zellulären Biotechnologie z.B. im Bereich Tissue Engineering, Zellanalysen und Transfektionsarrays. Entscheidend dabei ist die kontrollierte Abgabe lebender Zellen auf das entsprechende Substrat. Mit der am Institut zur Verfügung stehenden Technik können lebende Zellen gezielt auf Oberflächen dispensiert werden um diese für weitere Untersuchungen zur Verfügung zu stellen. Die Überlebensrate der Zellen beträgt bis zu 95 %. Damit steht eine Technik zur Verfügung, um eine große Bandbreite an unterschiedlichen Fragestellungen zu adressieren. Bei Transfektionsarrays werden die Zellen auf ein Gemisch aus Transfektionsreagenz und DNA dispensiert, wodurch die Zellen die DNA aufnehmen. Bei der DNA kann es sich z.B. um proteincodierende Vektoren oder RNAi Konstrukte handeln. Nach der Transfektion können die Zellen charakterisiert werden. Mit dieser Methode ist es möglich eine große Anzahl an DNA-Konstrukten parallel und unter identischen Bedingungen zu testen. Eine andere Anwendung von Zellmikroarrays ist das Dispensieren von verschiedenen Zelltypen auf (vor-)strukturierte Oberflächen. Damit kann zum einen die Interaktion von den Zellen untersucht und charakterisiert werden und zum anderen gewebeähnliche Strukturen und Zellpopulationen geschaffen werden.
Peptidmikroarrays

Eine Herausforderung bei Proteinmikroarrays ist das funktionelle Aufbringen von Membranproteinen. Als Alternative bieten sich Peptidmikroarrays. Hier können von einzelnen Proteinen bis zu dem gesamten Proteom von Zellen die Proteine als Peptide dargestellt werden. Zum Herstellen von Peptidmikroarrays wird bei hochdichten Peptidmikroarrays auch die SPOT Synthese oder ähnliche Methoden verwendet. Am Institut werden in der Regel kundenspezifische Peptidmikroarrays hergestellt, bei denen die Peptide gekauft und nach einer Qualitätskontrolle in definierten Konzentrationen bzw. -reihen in mehreren Replikaten immobilisiert werden. Im Gegensatz zu Proteinen können sich Peptide in ihren physiko-chemischen Eigenschaften wie isoelektrischer Punkt und Hydrophobizität sehr stark unterscheiden. Mit der verfügbaren Technik können für jedes einzelne Peptid die idealen / optimale Bedingungen vorgegeben werden und alle Peptide verlässlich und reproduzierbar in kleinsten Volumina auf verschiedenste Oberflächen und Strukturen dispensiert werden.
Anwendungen für Peptidmikroarrays sind u.a. das Identifizieren von Antigenen Bereichen von Oberflächen Proteinen bei bakteriellen Keimen und das Identifizieren von Immunogenen, das Epitopmapping und die Bestimmung der Spezifität von Antikörper, Serumprofiling zum Identifizieren und Validieren von Biomarkern, Charakterisierung von Enzymen (z.B. Targetidentifizierung oder medizinische Applikationen wie das HLA-Profling und die Stratifizierung von Patienten.
Proteinmikroarrays

Bei Proteinmikroarrays werden Proteine auf modifizierten Objektträgern (Slides) aufgebracht und immobilisiert. Dafür können die entsprechenden Proteine entweder rekombinant hergestellt werden, aus cDNA bzw. Expressionsbanken oder Proteinmikroarrays ausgehend von DNA-Mikroarrays mittels in vitro Transkription/Translation on demand hergestellt werden.
Die hergestellten Proteinmikroarrays können für zahlreiche, unterschiedliche Anwendungen verwendet werden. Am häufigsten werden diese Mikroarrays zur Identifizierung von Interaktionen eingesetzt. So können neben Protein-Protein Interaktionen auch Interaktionen zwischen den immobilisierten Proteinen mit kleinen Molekülen z.B. ATP und Medikamenten, der Einfluss von Co-Faktoren, Salzgehalt und pH auf Interaktionen, mit Lipiden und Kohlenhydraten untersucht werden.
Die Herausforderung bei der Herstellung ist, dass alle Proteine gleichmäßig und möglichst funktional immobilisiert werden. Dazu stehen verschiedene Techniken zur Verfügung. Die Bandbreite reicht von Adsorption auf Nitrocellulose über die kovalente Kopplung z.B. an Epoxy-modifizierte Oberfläche oder per Klick-Chemie bis hin zu Immobilisierung über Affinitätstags oder Antikörper.
Durch die Vielfalt an verfügbaren Technologien und der jahrelangen Expertise können viele Proteinklassen auf unterschiedlichste Oberflächen aufgebracht und für eine Analytik zur Verfügung gestellt werden.
DNA- und RNA-Mikroarrays/ Expressionsanalyse
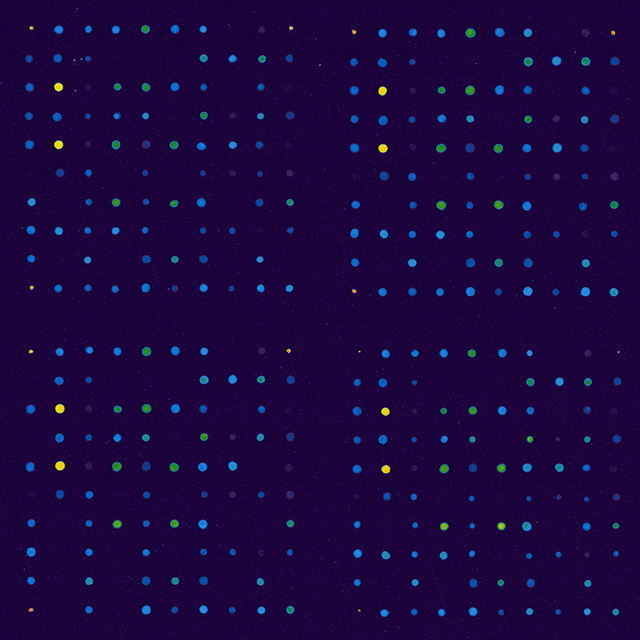
Für das Verständnis der komplexen regulatorischen Mechanismen und der Untersuchung der zellulären Mechanismen ist eine gleichzeitige Analyse der Expression aller Transkripte einer Zelle, einer Zellpopulation, eines Gewebes oder Organismus während einer definierten Zeitspanne unentbehrlich. Die vollständige genomische Sequenz von vielen Organismen wie dem Mensch, der Maus, Drosophila melanogaster und Caenorhabditis elegans sind inzwischen verfügbar. Mittels Second Generation Sequencing kann innerhalb weniger Tage die Information über die transkriptionelle Aktivität eines Organismus bestimmt werden. Die Methode ermöglicht es Gene zu identifizieren, die für komplexe Entwicklungsnetzwerke und Signaltransduktionswege erforderlich sind.
Basierend auf diesen Informationen können spezifische DNA- / RNA-Mikroarrays hergestellt werden, um die Veränderungen ausgewählter signifikanter Transkripte zu bestimmen. Anhand dieser Informationen kann z.B. eine Klassifizierung / Stratifizierung von Patienten vorgenommen werden oder Tests zur Unterstützung für eine Therapieentscheidung und -unterstützung entwickelt werden.
Der Schwerpunkt liegt auf dem Studium von menschlichem Krebsmaterial. Es werden Informationen gesammelt, um eine frühzeitige Diagnose, eine genaue Prognose, die Identifizierung potenziell interessanter Therapien sowie die Bewertung des Erfolgs der Krankheitsbehandlung zu ermöglichen. Neben der Analyse von RNA Transkripten können microRNAs aber auch epigenetische Änderungen bestimmt werden.
Serum Screening

Eine Hauptanwendung von Protein und Peptid Mikroarrays ist das Identifizieren von Antikörpern in Serum von Patienten. Das können krankheitsassoziierte Antikörper z.B. bei Krebserkrankungen und Rheuma vom Typ IgG und IgM aber auch Antikörper bei Allergien (Typ IgE) oder gegen bakteriellen und viralen Infektionen. Je nach Fragestellung werden dazu die Proteine, Teile der Proteine als Peptide oder das gesamte (Sub-)Proteom auf einem Microarray immobilisiert und mit Serum inkubiert. Die Detektion erfolgt mittels spezifischer Antikörper gegen die entsprechende IgG Familie. Bei Bedarf kann das Serum aufgereinigt werden und der Slide mit den konzentrationsnormierten IgGs inkubiert werden. Neben einer sorgfältigen Auswahl der potentiellen Antigene ist die Auswahl der Patientenseren ein kritischer Faktor. Auswahl bedeutet hier eine mögliche Stratifizierung der Patienten in Subfamilien, die Auswahl der entsprechenden Kontrollpatientenkohorte, die Anzahl der Patienten, der Zeitpunkt der Probennahme(n) sowie die Aufarbeitung und Lagerung der Seren von Probennahme über Transport bis hin zur Analyse. Ausgehend von diesen Faktoren können Microarrays ein sehr aussagekräftiges Instrument sein um krankheitsassoziierte Biomarker zu identifizieren und zu validieren.
Zusätzlich können solche Microarrays verwendet werden um Serotypen zu bestimmen und basierend auf den Daten bei Transplantationen eine Vorhersage zur Verträglichkeit bzw. dem Risiko einer Abstoßung des Transplantates zu treffen. Bisher sind weit über 1.000 unterschiedliche HLA Genotypen beschrieben. Zur Analytik stehen nur ca. 100 Genotypen als Protein zur Verfügung. Die Limitierung hierbei ist die aufwendige Expression und Reinigung der HLA Proteine, bei der die 3-dimensionale Konformation erhalten bleiben muss. Hier können Protein Microarrays bzw. Peptid Microarrays mit zyklisierten Peptiden ein wertvolles Hilfsmittel sein, um diese Limitierungen zu überbrücken.
Antikörpercharakterisierung

Bei allen Mikroarray-basierten Methoden sind gut charakterisierte und validierte Antikörper essentiell. Die gewonnenen Daten hängen im Wesentlichen von der Qualität der verwendeten Antikörper ab. Aktuelle Studien zeigen, dass zum Teil weniger als 20% der verwendeten und kommerziell erhältlichen Antikörper für Assayentwicklungen und aussagekräftige (klinische) Studien verwendet werden können. Unspezifische Antikörper können auf Grund der Kreuzreaktivität mit anderen Targets sowohl die Menge an Antigen falsch wiedergeben (Ja/Nein Antwort), zu Falsch positiven und negativen Klassifikationen führen als auch die biologische/medizinische Aussage eines Experimentes beeinflussen.
Generell sollte von jedem Reagenz (Antigen und Antikörper) vor einem Versuch eine gründliche Qualitätskontrolle durchgeführt werden. Dazu zählen auch neue Chargen und Batches von Reagenzien bei Neubestellungen.
Hier hat die Abteilung aufgrund der jahrelangen Arbeit bei der Entwicklung von Assays im (bio-)analytischen Bereich eine umfangreiche Expertise erworben. Neben klassischen Methoden wie ELISA und Western Blot Analysen können Antikörper mittels Peptid Microarrays charakterisiert werden und kinetische Daten gewonnen werden. Gerade bei der Entwicklung von diagnostischen und (bio-)analytischen Methoden ist die Art der Antikörpercharakterisierung entscheidend. So können Antikörper in einem Assay spezifisch ihr Target erkennen, jedoch auf einer anderen Plattform unter anderen Bedingungen Kreuzreaktivitäten zeigen. Das vorhandene Wissen um die Übertragbarkeit von Ergebnissen zwischen einzelnen Plattformen und Techniken ist eine wichtige Expertise der Abteilung in diesem Bereich.
Analyse von Signalwegen
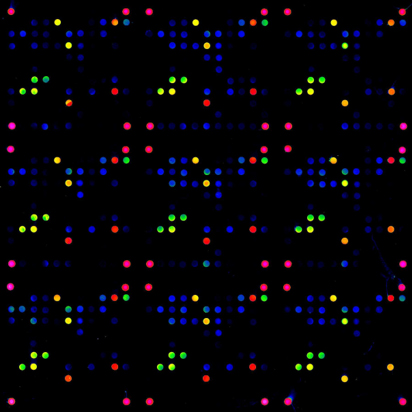
Zur Analyse von Signalwegen haben sich neben in vivo Methoden etliche in vitro Methoden in den letzten Jahren durchgesetzt. Eine der Methoden die immer weitere Verbreitung findet sind Reverse Phase Microarrays. Dabei wird der Extrakt von Zellen z.B. von einer Biopsie oder von Zellen mit und ohne Stimulus in einer Konzentrationsreihe auf Slides gespottet und mit spezifischen Antikörpern (z.B. phospho-spezifische Antikörper) inkubiert. Die Signalintensität erlaubt Rückschlüsse über Veränderungen der Proteine. Veränderungen können z.B. die Abundanz der Proteine sein oder post-translationale Modifikationen. Der Vorteil von Microarrays sind das geringe Probenvolumen, eine hohe Anzahl an technischen Replikaten und die Möglichkeit sehr viele Proben unter identischen Bedingungen zu testen. Dadurch lassen sich Zeitverläufe genauso untersuchen wie die Analyse von Signalwegen oder die »Reaktion« von Zellen (Gewebe) auf externe Stimuli, um damit Rückschlüsse auf den Wirkmechanismus ziehen.
Reiternavigation
Leistungsangebot
Leistungsangebot
- Herstellung (Spotten) kundenspezifischer DNA-, Peptid-, Protein- und Zell-Mikroarrays
- Kompetenzzentrum Dispensiertechnologien
- Spotten auf unterschiedlichen Materialien, z. B. Glas, Plastik, Membranen, Mikrotiterplatten, Leiterbahnen, etc.
- Benchmarking diverser Kontakt- und Nicht-Kontakt-Spotter zur Auswahl des optimalen Systems (Referenzlabor für Liquiddispensiersysteme)
- Durchführung von kundenspezifischen Mikroarray-Experimenten, Auswertung und Dokumentation
- Optimierung der Experimente durch thermodynamische und kinetische Messungen
- Übertragung anderer Assayformate auf Mikroarrays, als Lateral-Flow-Test und für in vitro Diagnostik Anwendungen
- Entwicklung und Etablierung von Assays für ELISA und Mikroarrays
- Kolorimetrische, Fluoreszenz und elektrochemische Nachweissysteme
Methoden und Geräte
Methoden
- Dispensieren von biologischen Flüssigkeiten / Proben im pL bis µL Volumen
- kontakt und nicht-kontakt basierte Verfahren
- Dispensieren auf unterschiedlichsten Oberflächen
- Immobilisierung von (Bio)Moleküle
- Qualitätskontrolle der hergestellten Mikroarrays
- Oberflächencharakterisierung
- Bestimmung der Beladungs- / Immobilisierungsdichte
- Modifikationen und Beschichtungen von Oberflächen
Geräte
- I2-400 (Firma M2)
- S5 (Firma Scienion)
- S7 (Firma Scienion)
- S100 (Firma Scienion)
- Genetics
- Top Spotter
- Kontaktwinkelmessung, Elipsometrie
- bScreen (Biamterics)
 Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB
Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB