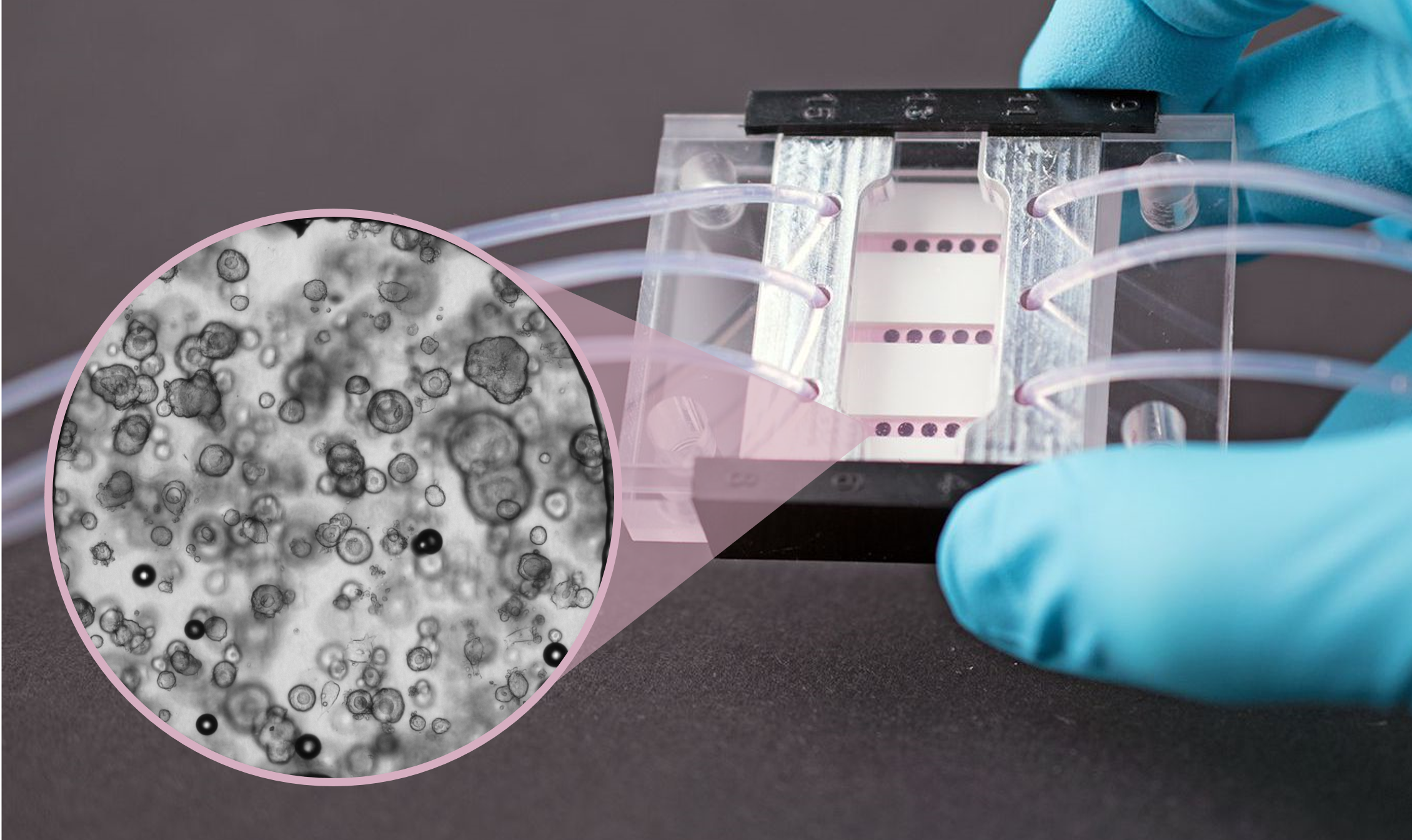
Animation der Zelleinsaat und Assemblierung des Organ-on-Chip-Systems.
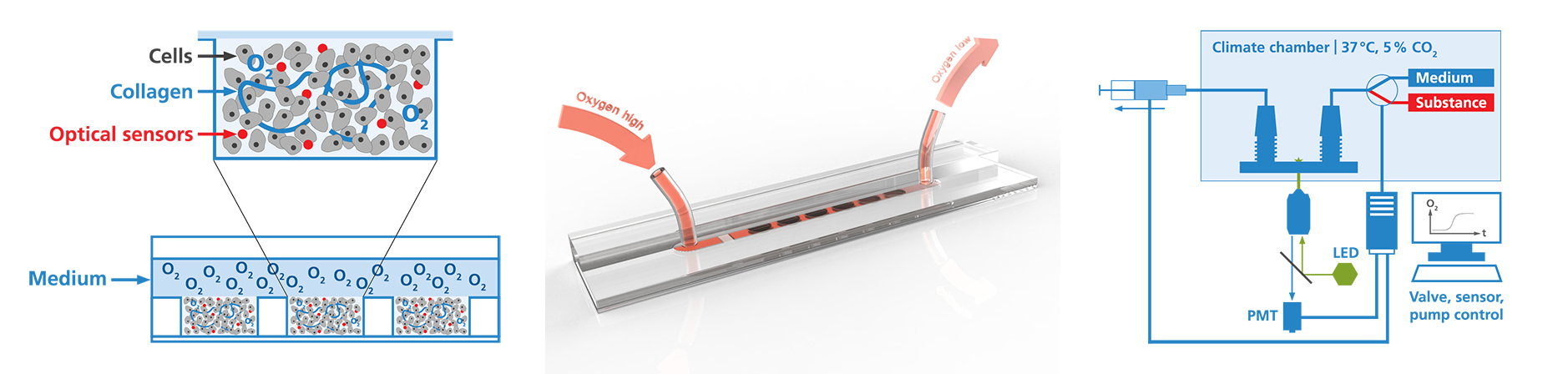
In-vitro-Zellmodelle werden als Krankheitsmodelle, für Wirkstoffscreening und Toxizitätstests sowie bei grundlegenden Untersuchungen zur Entwicklung und Organisation diverser Gewebearten eingesetzt. Basierend auf unserer Expertise in den Bereichen Zellbiologie, Materialwissenschaften und Beschichtungen, sowie Mikrosensorik und Mikrofluidik (Design, Fertigung und Integration) entwickeln wir Mikroreaktoren für Kurz- und Langzeituntersuchungen an Zellgewebe. Diese Reaktoren gewährleisten eine Zellkultur unter kontrollierten physiologischen Bedingungen. Die Integration von Mikrosensoren in diese Systeme ermöglicht es erstmals in Echtzeit Zellvitalität oder Stoffwechselprodukte bis zu einem Monat kontinuierlich zu vermessen. Im Vergleich zu konventionellen Endpunktmessungen bietet dieser Ansatz einen sehr viel direkteren Zugriff auf das Verständnis von Wirkstoffmechanismen. Neben Konzepterstellung und Entwicklung von Mikrobioreaktoren bieten wir die Durchführung von in-vitro-Untersuchungen zur Bewertung der Lebertoxizität von chemischen Stoffen an.
 Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB
Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB