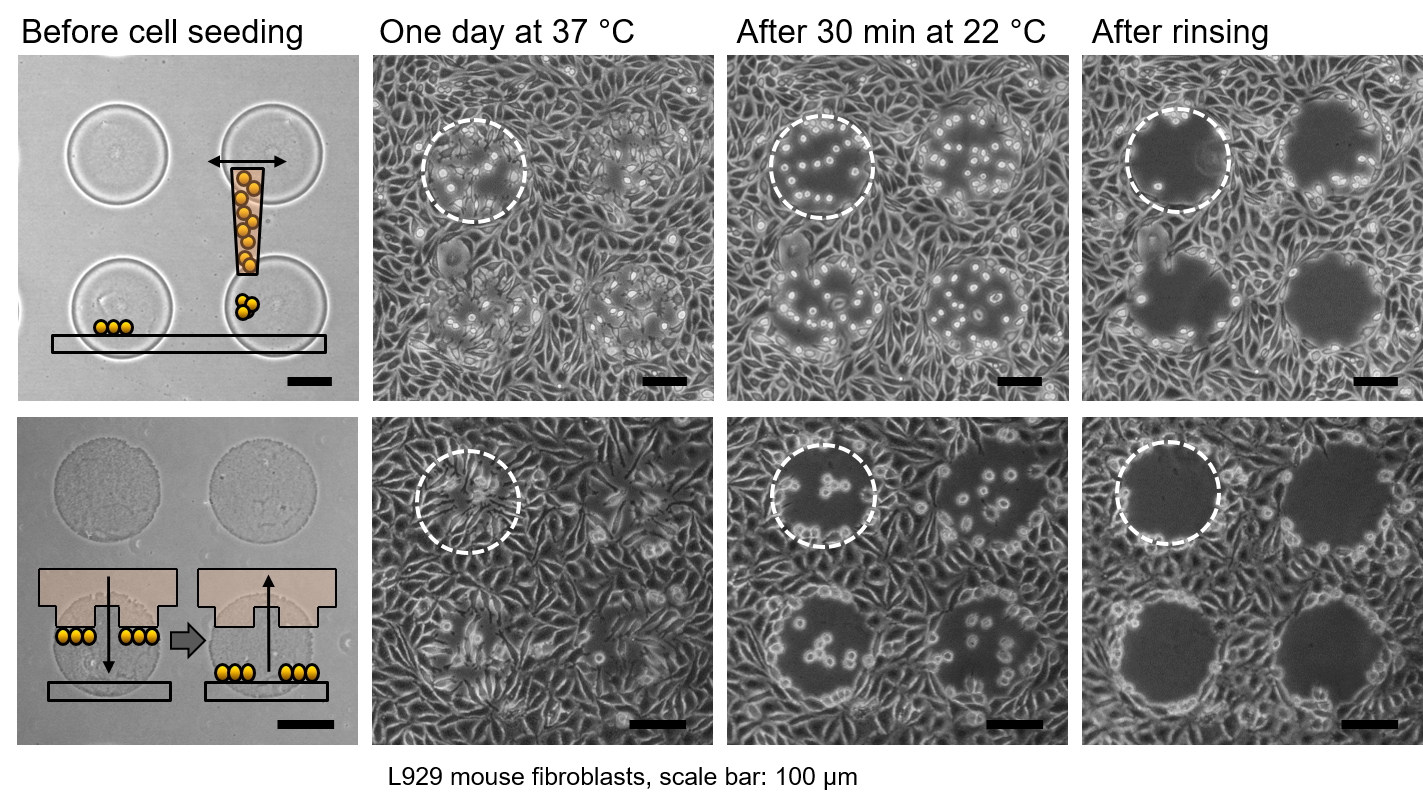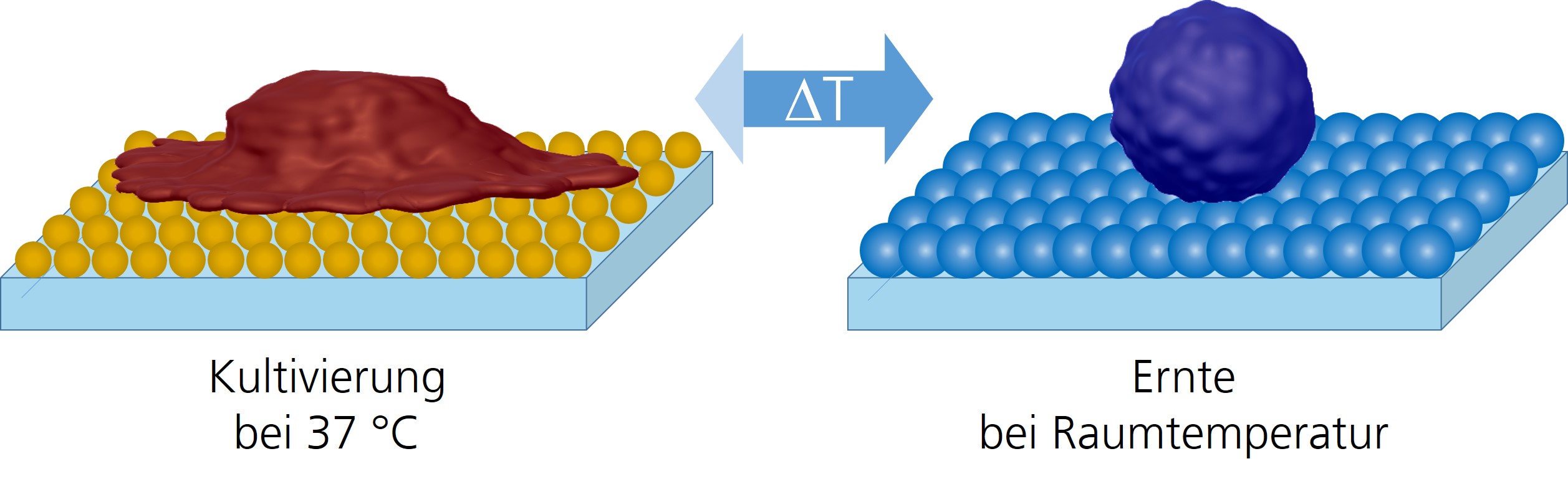
Wir entwickeln Beschichtungen aus thermoresponsiven Polymeren für Zellkulturanwendungen mit dem Ziel, Zelladhäsion effektiv und schonend zu kontrollieren. Bei typischen Kultivierungstemperaturen adhärieren und proliferieren die Zellen wie auf einem Standardzellkultursubstrat. Wird die Temperatur um wenige Grad reduziert, lassen sich die Zellen durch einfaches Spülen von diesen Beschichtungen ablösen. Der Verzicht auf invasive Proteasen stellt sicher, dass die Zellvitalität und Membranproteine bei diesem kritischen Prozessschritt nicht beeinträchtigt werden. Die Polymere können homogen oder in definierten Mustern mit einfachen Methoden, wie Spin-Coating, Spray-Coating, Spotting oder Drucken, auf gängigen Zellkultursubstraten kostengünstig aufgetragen werden. Neben dem Einsatz als Zellkultursubstrat eignet sich die Polymerbeschichtung für Zelltests, die eine Untersuchung der Zellmigration erlauben (z.B. Wundheilungstest) oder für die Etablierung von Co-kulturen mit definierten geometrischen Beziehungen.
 Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB
Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB