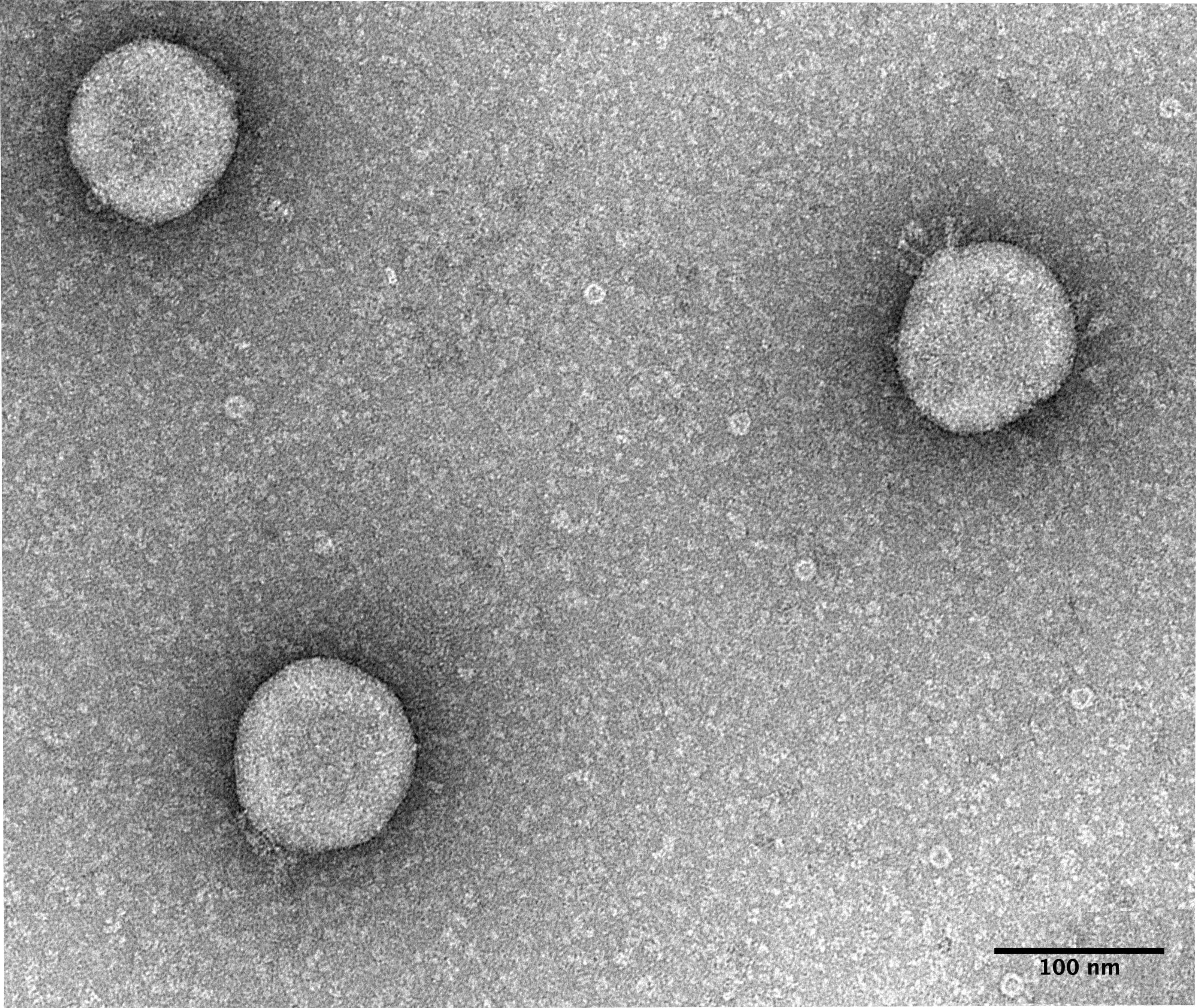
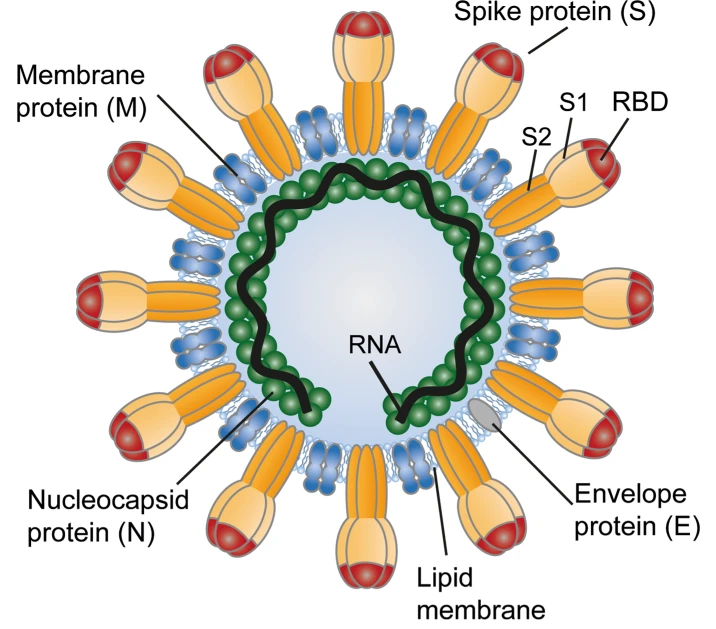
Wie stark binden SARS-CoV-2-Viren an den hACE2-Rezeptor?
switchSENSE-Technologie zur quantitativen Bestimmung
von Virus-Rezeptor-Bindungen
Zum Thema Charakterisierung von Bindungsinteraktionen des SARS-CoV-2 Virus publizierten unter anderem Marlen Kruse und David M. Smith kürzlich in Nature Scientific Reports. Sie entwickelten trivalente Peptid-DNA-Nanostrukturen, die die Bindestelle des menschlichen Rezeptors imitieren. Die Bindung dieses Peptids an verschiedene Domänen des Spike-Proteins und an komplette Viruspartikel des SARS-CoV-2-Virus wurde sowohl mit ELISA- als auch mit switchSENSE-Technologie untersucht. Dabei zeigte sich, dass schon kleine Änderungen in der Aminosäuresequenz des Spike-Proteins die Bindung an den Rezeptor drastisch beeinflussen können.
Die Corona-Pandemie hat die Leben aller verändert und sehr viele Leben gekostet. In Deutschland sind wir gerade im Übergang in einen endemischen Zustand. Das bedeutet, dass das SARS-CoV-2-Virus für die Bevölkerung nicht mehr so gefährlich ist, aber auch, dass es bei uns dauerhaft anzutreffen sein wird. Eine profunde Wissensgrundlage der Eigenschaften und des Verhaltens des Virus wird also auch in Zukunft sehr wertvoll sein. Denn Impfungen schützen zwar gut vor schweren Verläufen von COVID 19, aber effektive Behandlungen und therapeutische Ansätze sind immer noch eine Herausforderung.
Präparierte Peptide als Rezeptoren
Die genaue Untersuchung der Bindeinteraktionen zwischen dem Spike-Protein des Virus und den Rezeptoren auf der Oberfläche der menschlichen Zellen trägt wesentlich zum Verständnis der Vorgänge im Verlauf der Infektion bei. Für die Experimente wurden Peptid-DNA-Strukturen verwendet, um den menschlichen Rezeptor als Bindestelle für die Viren zu imitieren. Das verwendete Peptidfragment ist ein Nachbau der Rezeptorstelle des menschlichen Angiotensin-konvertierenden Enzym 2 (hACE2) und wurde von Dr. David M. Smith am Fraunhofer IZI in der Arbeitsgruppe »DNA-Nanosysteme« in eine DNA-Gerüststruktur integriert. Diese Peptid-DNA-Strukturen werden für die Untersuchung auf einem Träger immobilisiert und dann den Viren oder den Spike-Proteinen präsentiert.
Wo die Fluoreszenz fehlt, da haftet ein Spike-Protein.
Am Fraunhofer IZI-BB untersuchte Marlen Kruse, aus der Arbeitsgruppe »Biomolekulare Nanostrukturen und Messtechnik« von PD Dr. Ralph Hölzel das Bindungsverhalten über ELISA (Enzyme Linked Immunosorbent Assay) sowie über das fluoreszenzbasierte Verfahren switchSENSE. Dabei konnte sie teilweise Bekanntes bestätigen, aber auch bisher unbekannte Verhaltensweisen entdecken.
Für die Untersuchung über die switchSENSE-Technologie wurde das Peptidfragment an einer DNA-Struktur immobilisiert, die mit einer fluoreszierenden Molekülgruppe ausgestattet ist. Wenn die Reaktionslösung mit den Spike-Proteinen über die immobilisierten Peptide fließt, können die Spike-Proteine daran binden. Das führt dazu, dass an allen Peptidgruppen, an die das Spike-Protein gebunden hat, die Fluoreszenz zurückgeht. Die Fluoreszenzstärke ist also umgekehrt proportional zur Anzahl der eingegangenen Bindungen und macht das Bindeverhalten quantifizierbar.
Um das Vorgehen und die Ergebnisse einordnen zu können, muss man die Geometrie des Spike-Proteins verstehen. Dieses ist aus drei identischen Monomeren aufgebaut und weist eine dreizählige Drehsymmetrie auf, in der das Protein auch rotieren kann. Die Monomere bestehen zudem aus zwei Domänen - der Domäne S2, welche in die Lipidmembran eintaucht, und der Domäne S1, die nach außen gerichtet ist. Der nach außen hin exponierte Teil der S1 Domäne wird auch als Rezeptorbindungsdomäne (RBD) bezeichnet.
Für die Bindung bisher unterschätzte Domänen
Sowohl mit ELISA als auch mit der switchSENSE-Technologie konnten Marlen Kruse und ihr Projektteam bestätigen, dass zwischen dem untersuchten Peptidfragment und der Rezeptorbindungsdomäne des Spike-Proteins keine stabile Bindung entsteht, was sogar auch für den größeren Teil der S1 Domäne gilt. Dieses Ergebnis scheint nicht intuitiv, wurde aber auch schon von anderen Forschungsgruppen bestätigt.
Überraschend war, dass das vollständige Spike-Protein, bestehend aus der S1 und S2 Domäne, tatsächlich eine starke Bindung zum Rezeptor eingeht, deren Stärke allerdings sehr variabel ist. Veränderungen einzelner Aminosäuren in weiter Entfernung zur Rezeptorbindungsdomäne können die Stabilität der Bindung entscheidend beeinflussen. Im weiteren Verlauf der Versuche wurden auch Interaktionsmessungen mit vollständigen Viren durchgeführt, die ebenso an die präsentierten Peptide banden. Hier wurde das unterschiedliche Bindungsverhalten verschiedener Mutationen deutlich sichtbar. Dafür wurden Alpha- und Beta-Varianten von SARS-CoV-2 mit dem inaktivierten Wildtyp des Virus verglichen.
Dreifachpräsentation des Peptids stärkt die Bindung
Da das Spike-Protein als Trimer auftritt, wurde auch eine Vielfachpräsentation der Peptidsequenz getestet. Über switchSENSE lässt sich hier, im Unterschied zu ELISA, die Veränderung der Dissoziationskonstante sehr gut quantifizieren. Durch das Aufbringen von 3 Peptidbindern auf die DNA-Gerüststruktur konnte die Bindung tatsächlich verstärkt werden - interessanterweise ebenfalls um das Dreifache.
Strukturen auf Peptidbasis, wie in diesem Projekt eingesetzt, sind potentielle Kandidaten für Anwendungen in der Diagnostik und für die Therapie. Dabei ist dieser Ansatz nicht auf SARS-CoV-2 beschränkt und könnte auch bei anderen Virusinfektionen genutzt werden.
Im Endergebnis zeigen die Versuche, dass die Rezeptorpeptide des hACE2-Enzyms nur an das Spike-Protein binden, wenn ihnen komplette Spike-Proteine präsentiert werden. Die Rezeptorbindungsdomäne des Virions scheint überraschenderweise nicht ausreichend zu sein, um eine starke Bindung aufzubauen. Die Bindungsstärke hängt wiederum von der Variante des Virus ab. Mit switchSENSE können problemlos ganze, native Viren wie auch Monomere und Trimere des Spike-Proteins untersucht werden, was für die Anwendung vorteilhaft sein kann. Für die Entwicklung neuer Therapeutika könnte es entscheidend sein, die Affinität über oligovalente Bindungsmodi genau zu justieren. Studien wie diese helfen uns, das Verhalten von SARS-CoV-2 zu entschlüsseln, und bringen uns deutlich voran auf dem Weg zu effektiven Behandlungsmöglichkeiten.
 Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB
Fraunhofer-Institut für Zelltherapie und Immunologie, Institutsteil Bioanalytik und Bioprozesse IZI-BB